|
고 망간(Mn) 합금강 및 합금철의 정련기술
박 주 현 (울산대학교 첨단소재공학부)
최근 차세대 자동차 또는 에너지/발전 소재용 오스테나이트계 망간 합금강의 개발이 주목을 받고 있다. 이는 Mn의 다량 (5~30) 첨가를 통해 고강도/고연성을 동시에 확보할 수 있기 때문이며, 변태유기소성 (혹자는 소성유기변태라 함) 현상과 쌍정유기소성 현상을 바탕으로 한 TRIP (Transformation-Induced Plasticity) 또는 TWIP (Twinning-Induced Plasticity) 강재 개발을 들 수 있다. 이렇게 우수한 기계적 특성에 더하여 자동차 강판의 경우 경량화에 의한 연비향상 및 온실가스 저감이라는 화두로 인해 알루미늄 (Al) 첨가량이 점차 증가하고 있으며, 특히 고Mn강에서 Al의 첨가는 수소지연파괴 방지에 효과적인 원소로 알려져 있다. 따라서, 우리나라와 독일 등을 중심으로 Mn-Al 합금강 (High Mn & Al alloyed Steels; HiMAS) 개발이 주도적으로 이루어지고 있음에도 불구하고 이를 상용화하기 위한 제조공정, 특히 정련 및 (연속)주조 공정에서 해결되어야 할 문제점들이 많은 것이 현실이다. 특히 Mn, Al 함량이 높은 조건에서 슬래그/용강 계면에서의 격렬한 반응에 의한 용강 및 슬래그의 조성과 물성 변화, 산화물/유화물/질화물계 비금속 개재물의 생성문제 등이 해결되어야 한다. 이와 같이 HiMAS 강재의 생산을 위해서는 대량의 Mn 합금철이 투입되는데, 기존의 철강재 생산에 있어서는 Mn 합금철 중 C, S, P, N, O 등 불순원소들의 허용치가 다소 높아도 큰 문제가 되지 않았으나, HiMAS 강재의 생산을 위해서는 부원료인 합금철의 성분 고도화가 함께 이루어져야 한다. 따라서, 최근 Mn 합금철 제조사들 역시 불순원소의 정련 문제를 시급히 해결해야 하는 과제에 당면해 있다. 이에 최근 울산대학교 고온물리화학소재공정연구실 (Laboratory for HIgh TEmperature Physicochemical Processing of materials; HITEP2) 중심으로 연구되고 있는 내용들을 소개하고자 한다.
l HiMAS 강재의 정련 특성 및 비금속개재물 생성 메커니즘 그림 1에 Mn=10~20, Al=1~6의 고합금 용강 중 생성되는 비금속 개재물의 3차원 형상을 7가지의 타입으로 분류하여 나타내었으며, 다음과 같이 구분할 수 있다.
1) Al2O3 ;
single alumina particle
2) AlN or AlON ; single aluminum nitride
or oxy-nitride particle
3) MnAl2O4 ;
single galaxite spinel particle
4) Al2O3(-Al(O)N)
agglomerate
5) Mn(S,Se) ; single manganese
sulfur-selenide particle
6) Oxide core with a Mn(S,Se) skin
(wrap)
7) Mn(S,Se) core with an Al2O3(-Al(O)N)
aggregate (or bump) 여기서 MnS가 아닌 Mn(S,Se) (type 5~7) 복합개재물의 관찰이 매우 흥미로운데, 이는 일반적으로 고순도 전해망간 제조 시 셀효율 향상을 위해 전해액에 셀레늄(Se)이 첨가되고 이로 인해 전착된 고순도 Mn 중에는 약 0.1 또는 그 이상의 Se이 불순물로 잔류하기 때문이다. 따라서, 일반적으로 고순도 Mn을 첨가하여 합금을 용해한 후 이를 바탕으로 소재개발에 주력하는 연구자들의 경우 Mn에 함유된 Se에 기인한 개재물 생성으로 많은 기계적/화학적 특성들이 저해될 수 있음을 주지할 필요가 있다.
.JPG)
Fig. 1 Morphologies of inclusions in HiMAS. From type
1) to 7). See text for explanation.
그림 2에는 HiMAS (Mn=10~20, Al=1~6) 용강과 CaO-SiO2(-MgO-Al2O3)계
슬래그와의 반응에 의한 Al 농도 감소, Si 농도 증가를
나타내었으며, Al 함량에 따라 반응속도는 1>>3>6Al
system 순으로 감소함을 알 수 있다. 이는 일반적으로 Al 함량이 증가할수록 반응속도가 증가할 것이라는 열역학적 예상과 상반되는 결과로서 물질이동현상에 기초한 속도론적
이해를 바탕으로 설명될 수 있다. 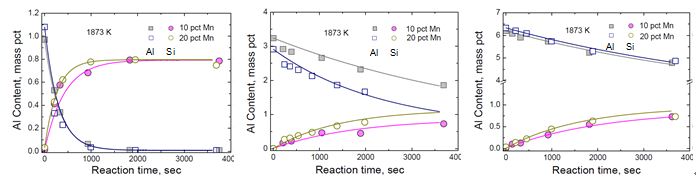
Fig. 2 Changes in the content of Al and Si in HiMAS
with 1, 3, and 6Al as a function of time at 1873 K.
그림 3은 HiMAS 용강과 슬래그 반응 후 슬래그-용강 계면관찰 결과를 나타낸
것으로 Al=1일 경우 슬래그는 비정질의 균일상이거나 또는 미세한
(Mg,Mn)Al2O4 결정상이 국소적으로 석출한 반면,
Al=3~6일 경우 슬래그 층에는 조대한 MgAl2O4와 CaAl4O7 결정상이 대량으로 석출해있음을 알 수 있다. 결과적으로 HiMAS 중 Al 함량 3 이상일 때 조대한 석출상들로 인해 슬래그의 겉보기 점도가 급격히 상승하고 결과적으로 물질이동에 의한 반응속도를
지연시키게 된다.
.JPG)
Fig. 3 SEM-EDS analysis for the slag-metal
interface in case of 1Al, and 3~6Al-containing HiMAS.
l Mn
합금철의 불순물 정련 메커니즘
Mn 합금철
제련 시 일반적으로 CaO-MnO-SiO2(-Al2O3-MgO)계
슬래그에 의해 불순물 정련반응이 진행되며, 그림 4에 MnO-계 슬래그의 S 흡수능을 나타내었다. 슬래그의 SiO2 함량이 약 30 이상일 때, 이온화 경향이 상대적으로 큰 Ca2 이온이 silicate 음이온 구조를
해리하는데 우선적으로 소모되므로 상대적으로 자유로운 Mn2 이온이 S2- 이온의 안정화에 크게 기여하기 때문에 MnO 함량이
증가할수록 S 흡수능은 증가한다. 반면, 슬래그의 SiO2 함량 30 이하에서는 해리되어야 하는 silicate의 양이 적으므로, 일부 Ca2 이온이 silicate 음이온 구조와 평형을 이루더라도 대부분의 Ca2
이온은 S2- 이온의 안정화에 기여하게 된다. 따라서 저 SiO2 영역에서는 MnO 함량이 증가할수록 S 흡수능이 감소하며, 결과적으로 시계방향으로 회전하는 형상의 S 흡수능을 나타낸다. 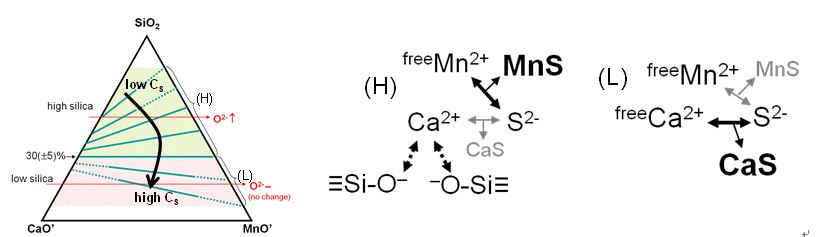
Fig. 4 Competitive sulfur dissolution mechanism in Ca–Mn–silicate
slags.
한편 SiMn
합금철 용탕 중에서 C 정련을 위해서는 SiMn 용탕에 Si을 포화 용해도 이상으로 투입하여 SiC 입자를 석출시키고, 이들 SiC 입자를 용탕 상부로 부상시켜 제거한다. 이 때 SiC 입자와 슬래그간의 계면반응 메커니즘 규명을 위해 SiC/MnO-slag 계면반응을 실시간으로 관찰하여 그림 5와 같은
메커니즘을 규명하였다. 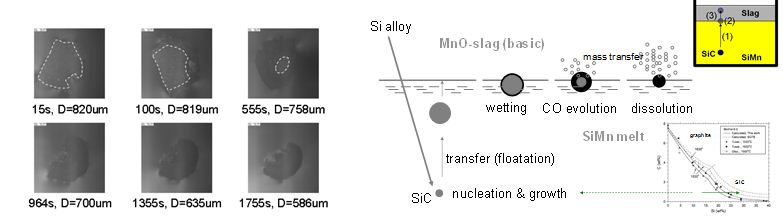
Fig. 5 Dissolution sequence of SiC particle in MnO-slag
and teh removal mechanism of SiC in SiMn melt.
이상과 같이 최근 이슈가 되고 있는 HiMAS
뿐 아니라 Mn계 합금철의 제련 및 정련 프로세스에서 일어나는 현상에 대한 이해를 도모하고, 나아가 제반 문제들을 해결할 수 있는 실마리를 찾기 위해 UOU-HITEP2
연구실에서는 오늘도 10여 명의 연구진들이 고온물리화학 기초연구에 매진하고 있다. 전술한 연구내용에 대한 상세내용 및 미처 수록하지 못한 관련 연구내용들에 관해서는 아래 문헌들을 참고할 수
있다.
1)
J.H. Park, G.H. Park and Y.E. Lee: ISIJ Int., vol. 50, (2010), pp. 1078-1083.
2)
J.H. Park, J.G. Park, D.J. Min, Y.E. Lee and Y.B. Kang: J. Eur. Ceram. Soc., vol. 30, (2010), pp. 3181-3186.
3)
G.H. Park, Y.B. Kang and J.H. Park: ISIJ Int., vol. 51, (2011), pp. 1375-1382.
4)
J.H. Shin, J. Lee, D.J. Min, and J.H. Park: Metall. Mater. Trans. B, vol. 42B,
(2011), pp. 1081-1085.
5)
Y.B. Kang and J.H. Park: Metall. Mater. Trans. B, vol. 42B, (2011), pp. 1211-1217.
6)
J.H. Park, and G.H. Park: ISIJ Int., vol. 52, (2012), pp. 764-769.
7)
J.H. Park, D.J. Kim, and D.J. Min: Metall. Mater. Trans. A, vol. 43A, (2012), pp.
2316-2324.
8)
D.J. Kim and J.H. Park: Metall. Mater.
Trans. B, vol. 43B, (2012), pp. 875-886.
9)
J.H. Park: ISIJ
Int., vol. 52, (2012), pp. 1633-1642.
|